
|
시장보고서
상품코드
1846176
전자 임상 결과 평가(eCOA) 솔루션 : 시장 점유율 분석, 산업 동향, 통계, 성장 예측(2025-2030년)Electronic Clinical Outcome Assessment Solutions (ECOA) - Market Share Analysis, Industry Trends & Statistics, Growth Forecasts (2025 - 2030) |
||||||
전자 임상 결과 평가(eCOA) 솔루션 시장 규모는 2025년에 21억 8,000만 달러, 2030년에는 45억 1,000만 달러에 이르고, CAGR 15.65%를 나타낼 것으로 예측됩니다.

환자 중심의 증거에 대한 규제 당국의 주목이 높아지고, 클라우드 네이티브 eClinical 스택으로의 급속한 이행, 분산형 테스트 모델의 광범위한 채용이 플랫폼 수요를 가속화하고 있습니다. 제약 스폰서는 이러한 시스템을 고신뢰성 환자 보고, 임상의 보고, 관찰자 보고 및 성과 결과 데이터를 수집하고 라벨링 및 상환에 반영하는 주요 메커니즘으로 간주합니다. 성숙한 벤더는 인수를 통해 제품 라인업을 확충하고 틈새 벤더는 인공지능에 의한 의사 결정 지원과 통합 지불 기능으로 차별화를 도모하고 있습니다. 신흥국은 다지역에서의 시험 실시를 촉진하는 코스트 메리트를 제공하는 것으로 더욱 추풍이 되고 있습니다.
세계의 전자 임상 결과 평가(eCOA) 솔루션 시장 동향 및 인사이트
제약 및 생명 공학 회사의 임상시험 아웃소싱 확대
스폰서가 핵심이 되는 창약활동을 우선시키기 위해 임상시험 실시에 관련된 업무수탁기관의 점유율이 확대되고 있습니다. 미국에서는 바이오 의약품 CRO 시장이 2033년까지 197억 5,000만 달러에 이를 것으로 예상되며, 이는 아웃소싱 의욕이 지속되고 있음을 나타냅니다. CRO는 현재 턴키 전자 임상 결과 평가(eCOA) 솔루션 플랫폼을 채택하여 통합된 데이터 수집, 무작위화 및 환자 참여 서비스를 대규모 스폰서에게 제공합니다. Suvoda와 Greenphire의 합병으로 대표되는 통합은 eCOA, 지불, 공급망 기능에 걸친 통합 생태계를 구축합니다. 유행 후 인재 부족 - 임상 연구원의 이직률은 25% 이상의 - 은 훈련받은 디지털 임상시험 담당자를 공급할 수 있는 외부 파트너의 선호를 강화합니다.
클라우드/SaaS 기반 전자 크리니컬 스택 확장
스폰서가 탄력성, 검증 자동화, 총 소유 비용 절감을 요구하기 때문에 클라우드 배포가 기존 웹 호스팅 모델을 능가합니다. FDA의 Computer Software Assurance 지침은 리스크 기반 검증을 지원하며 21 CFR Part 11의 요구 사항을 유지하면서 클라우드 배포 장벽을 줄입니다. Microsoft Azure와 같은 선도적인 공급자는 SOC 1, SOC 2, ISO/IEC 27001 기준을 충족하며 생명 과학 팀은 즉시 사용할 수 있는 보안 프레임워크를 활용할 수 있습니다. USDM과 같은 전문 기업은 패치 관리를 자동화하고 지속적인 감사 태세를 유지함으로써 동시 병렬로 연구를 수행하는 스폰서의 다지역 컴플라이언스를 가능하게 합니다.
데이터 보안 및 개인정보 침해 우려
FDA는 현재 연결된 의료 기술의 소프트웨어 BOM을 요구하고 있으며, eCOA 공급업체는 견고한 취약성 모니터링 프로그램을 유지해야 합니다. 유럽 GDPR(EU 개인정보보호규정)은 데이터 전송에 엄격한 제약을 가하고 스폰서는 지역별 데이터 거주 관리 및 다층 암호화를 도입해야합니다. FDA에 의한 2024년 Exer Labs에 대한 경고장 등의 강제조치는 불충분한 사이버 보안이 초래하는 경제적·풍평적인 위험성을 강조하는 것입니다. 알고리즘의 투명성에 대한 모니터링 증가로 인해 의료기관의 72%가 AI의 예측 모델을 정부가 모니터링하는 것을 지지하고 있으며, 공급업체는 머신러닝 로직을 명확하게 설명하도록 압박하고 있습니다.
부문 분석
많은 스폰서들이 확립된 데이터센터 계약에 의존하기 때문에 2024년 전자 임상 결과 평가(eCOA) 솔루션 시장 점유율은 웹호스트형이 74.23%를 차지했습니다. 이 모델은 친숙하고 감사에 대한 즉각성도 입증되었기 때문에 특히 지속성이 혁신성을 능가하는 후기 포트폴리오에서는 단기적인 선호도가 유지됩니다. 그러나 클라우드 네이티브 플랫폼은 2030년까지 연평균 복합 성장률(CAGR)이 16.23%를 나타낼 전망입니다. 이는 스폰서가 탄력적인 용량, 실시간 분석 및 자동화된 규제 업데이트를 요구하고 있음을 반영합니다. Microsoft Azure의 보안 인증과 FDA가 포함된 리스크 기반 검증은 클라우드 인프라가 데이터 무결성 요구 사항을 충족할 수 있다는 확신을 제공합니다.
스폰서는 워크로드를 단계적으로 이동시키고, 종종 초기 또는 관찰 시험으로 시작하고 내부 정책이 성숙되면 중요한 시험을 마이그레이션합니다. 레거시 웹 호스트 데이터베이스를 클라우드 분석 서비스에 연결하는 하이브리드 아키텍처는 기업이 마이그레이션 위험을 관리하는 데 도움이 됩니다. 그 결과 클라우드 솔루션은 전자 임상 결과 평가(eCOA) 솔루션 시장 규모를 확대하고, On-Premise 인스턴스는 국방 자금에 의한 감염 프로젝트와 같은 최대한의 데이터 관리가 필요한 틈새 시나리오로 후퇴할 것으로 예측됩니다.
지역 분석
북미는 42.21%의 점유율을 차지하며 전자 임상 결과 평가(eCOA) 솔루션 시장을 독점했습니다. 이 시장을 견인하고 있는 것은 엄격하면서도 명확하게 정의된 FDA 규제, 정교한 임상 연구 인프라, 환자 중심의 측정 기준의 조기 전개입니다. 컴퓨터 소프트웨어 보증 프레임워크를 포함한 지속적인 FDA 지침은 검증에 대한 기대를 명확히 함으로써 스폰서의 신뢰를 지원합니다. 미국이 이 지역의 매출의 대부분을 차지하고 있으며, 캐나다는 희귀질환을 위해 특화된 Day-1 액세스 프로그램을, 멕시코는 비용 효율적인 1상 시험 시설을 제공합니다.
아시아태평양은 CAGR 16.57%로 가장 빠른 확대를 기록하고 있는데, 이는 임상시험 정책의 조화, 국내 R&D 투자 증가, 환자 1인당 비용 절감 기대를 반영하고 있습니다. 중국의 임상시험 승인 스케줄의 합리화, 인도의 디지털 헬스 미션, 한국의 원격 의료 파일럿 등이 견고한 eCOA 백본을 필요로 하는 분산형 시험 디자인을 받아들이는 환경을 조성하고 있습니다. 하지만 데이터의 지역화 정책과 언어의 복잡성이 다르기 때문에 공급업체는 구성 가능한 주권 제어 기능을 갖춘 다중 테넌트 아키텍처를 제공해야 합니다.
유럽은 EMA의 조정과 각국의 전자 건강 의제에 의해 지원되고 여전히 안정적인 도입 국가입니다. 독일의 병원 디지털화 예산과 영국의 의약품 및 헬스케어 제품 규제청의 샌드박스는 종양학과 신경학에 있어서 센서 주도의 성과의 흡수를 자극합니다. 한편, GDPR(EU 개인정보보호규정) 컴플라이언스 비용으로 중소 바이오테크놀러지 기업은 사전 인증된 호스팅 구역을 보유하고 있는 명성 있는 공급업체와 제휴하여 대륙 전체에서 전자 임상 결과 평가(eCOA) 솔루션 시장 거래의 중단 없는 흐름을 확보하고 있습니다.
기타 혜택 :
- 엑셀 형식 시장 예측(ME) 시트
- 3개월간의 애널리스트 서포트
목차
제1장 서론
- 조사 전제조건과 시장 정의
- 조사 범위
제2장 조사 방법
제3장 주요 요약
제4장 시장 상황
- 시장 개요
- 시장 성장 촉진요인
- 제약기업이나 생명공학기업에 의한 임상시험 아웃소싱 확대
- 클라우드/SaaS 기반 e클리니컬 스택 확대
- 규제 당국에 의한 환자 중심의 의약품 개발의 추진
- 분산형 및 BYOD 임상시험 모델로의 변화 가속
- BYOD 대응 웨어러블이 디바이스 비용을 낮추고 컴플라이언스를 강화
- AI 주도의 어드히어런스 코칭이 PRO 데이터의 질 향상
- 시장 성장 억제요인
- 데이터 보안 및 프라이버시 침해 우려
- 높은 초기 도입 비용과 검증 비용
- eCOA에 정통한 임상 업무 종사자의 부족
- 디바이스의 불균일성에 의한 측정의 동등성의 위험
- 규제 상황
- Porter's Porter's Five Forces
- 신규 참가업체의 위협
- 구매자의 협상력
- 공급기업의 협상력
- 대체품의 위협
- 경쟁 기업 간 경쟁 관계
제5장 시장 규모·성장 예측
- 배포 모드별
- 웹 호스팅
- 클라우드 기반
- On-Premise
- 접근별
- 환자 보고 결과(PRO)
- 임상의 보고 결과(ClinRO)
- 관찰자 보고 결과(ObsRO)
- 성과 결과(PerfO)
- 최종 사용자별
- 제약 및 바이오제약 기업
- 계약 연구 기관(CRO)
- 기타
- 지역별
- 북미
- 미국
- 캐나다
- 멕시코
- 유럽
- 독일
- 영국
- 프랑스
- 이탈리아
- 스페인
- 기타 유럽
- 아시아태평양
- 중국
- 일본
- 인도
- 호주
- 한국
- 기타 아시아태평양
- 중동 및 아프리카
- GCC
- 남아프리카
- 기타 중동 및 아프리카
- 남미
- 브라질
- 아르헨티나
- 기타 남미
- 북미
제6장 경쟁 구도
- 시장 집중도
- 시장 점유율 분석
- 기업 프로파일
- Dassault Systemes(Medidata)
- Signant Health
- Clario(ERT Clinical)
- Oracle Corporation
- IQVIA Inc.
- Veeva Systems
- Parexel Intl. Corp.
- Kayentis
- Castor EDC
- WCG Clinical
- Mednet Solutions
- ArisGlobal
- Medable Inc.
- Suvoda
- TrialSpark
- eClinical Solutions LLC
- OpenClinica
- Anju Software
- CRF Health(Parexel)
- OmniComm Systems
- Castor(Cloud Solutions)
제7장 시장 기회와 전망
KTH 25.11.07The electronic clinical outcome assessment solutions market size stands at USD 2.18 billion in 2025 and is projected to reach USD 4.51 billion by 2030, advancing at a 15.65% CAGR.
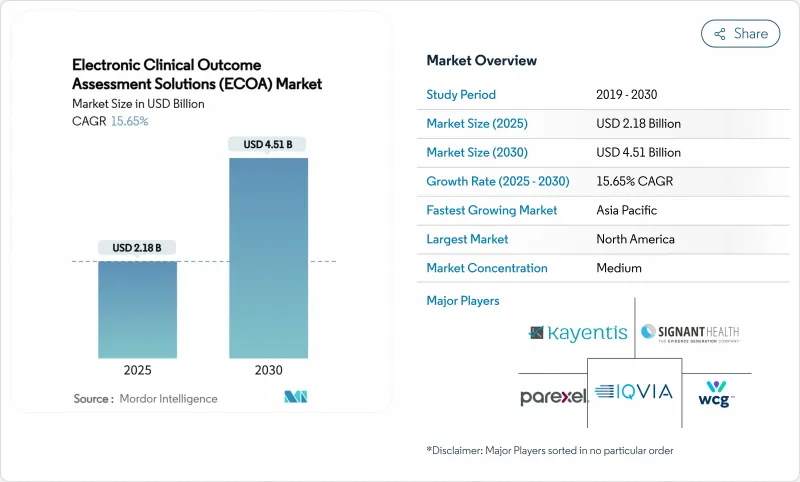
Intensifying regulatory focus on patient-centric evidence, rapid migration to cloud-native eClinical stacks, and the widespread adoption of decentralized trial models are accelerating platform demand . Pharmaceutical sponsors view these systems as the primary mechanism for collecting high-integrity patient-reported, clinician-reported, observer-reported, and performance outcomes data that inform labeling and reimbursement. Mature vendors keep broadening their suites through acquisitions, while niche players differentiate with artificial-intelligence decision support and integrated payment capabilities. Emerging economies add further tailwinds by offering cost advantages that encourage multi-regional trial execution.
Global Electronic Clinical Outcome Assessment Solutions (ECOA) Market Trends and Insights
Growing Outsourcing of Clinical Trials by Pharma & Biotech Sponsors
Contract research organizations handle an expanding share of trial execution because sponsors prioritize core discovery activities. In the United States, the biopharmaceutical CRO market is projected to reach USD 19.75 billion by 2033, a signal of enduring outsourcing appetite. CROs now adopt turnkey electronic clinical outcome assessment solutions platforms, offering sponsors unified data capture, randomization, and patient engagement services at scale. Consolidation, exemplified by the Suvoda-Greenphire merger, creates integrated ecosystems spanning eCOA, payments, and supply chain functions . Post-pandemic staffing shortages-Clinical Research Associate turnover rates exceed 25%-reinforce the preference for external partners capable of supplying trained digital-trial personnel .
Expansion of Cloud/SaaS-Based eClinical Stacks
Cloud deployments outpace legacy web-hosted models as sponsors seek elasticity, automated validation, and lower total cost of ownership. FDA's Computer Software Assurance guidance supports risk-based verification, reducing barriers to cloud adoption while preserving 21 CFR Part 11 requirements. Major providers such as Microsoft Azure meet SOC 1, SOC 2, and ISO/IEC 27001 standards, giving life-science teams out-of-the-box security frameworks. Specialized firms like USDM automate patch management and maintain continuous audit readiness, enabling multi-regional compliance for sponsors running concurrent studies.
Data-Security and Privacy-Breach Concerns
The FDA now requires a software bill of materials for connected medical technologies, compelling eCOA vendors to maintain robust vulnerability monitoring programs. Europe's GDPR adds strict data-transfer constraints, forcing sponsors to deploy regional data-residency controls and layered encryption. Enforcement actions-such as the FDA's 2024 warning letter to Exer Labs-underscore the financial and reputational hazards of inadequate cybersecurity. Rising scrutiny of algorithmic transparency leads 72% of healthcare organizations to favor government oversight of AI-driven predictive models, putting pressure on vendors to explain machine-learning logic in plain language.
Other drivers and restraints analyzed in the detailed report include:
- Regulatory Push for Patient-Focused Drug Development
- Shift Toward Decentralized & BYOD Trial Models
- High Upfront Implementation and Validation Costs
For complete list of drivers and restraints, kindly check the Table Of Contents.
Segment Analysis
Web-hosted deployments held 74.23% of electronic clinical outcome assessment solutions market share in 2024 because many sponsors rely on established data-center contracts. The model's familiarity and proven audit readiness sustain near-term preference, particularly for late-phase portfolios where continuity outweighs innovation. However, cloud-native platforms are expanding at a 16.23% CAGR to 2030, reflecting sponsors' drive for elastic capacity, real-time analytics, and automated regulatory updates. Microsoft Azure's security certifications and FDA-endorsed risk-based validation create confidence that cloud infrastructure can satisfy data-integrity mandates.
Sponsors shift workloads incrementally, often starting with early-phase or observational studies before migrating pivotal trials once internal policies mature. Hybrid architectures that tether legacy web-hosted databases to cloud analytics services help firms manage transition risk. As a result, cloud solutions are projected to capture a growing slice of electronic clinical outcome assessment solutions market size, while on-premise instances retreat to niche scenarios demanding maximal data control, such as defense-funded infectious-disease projects.
The Electronic Clinical Outcome Assessment Solutions Market Report is Segmented by Delivery Mode (Web-Hosted, Cloud-Based, On-Premise), Approach (Patient-Reported Outcome (PRO), and More), End User (Pharmaceutical and Biopharmaceutical Companies, Contract Research Organisations (CROs), Others), and Geography (North America, Europe, Asia-Pacific, and More). The Market Forecasts are Provided in Terms of Value (USD).
Geography Analysis
North America dominates the electronic clinical outcome assessment solutions market with 42.21% share, driven by stringent yet well-defined FDA regulations, sophisticated clinical research infrastructure, and early deployment of patient-centric metrics. Continuous FDA guidance, including the Computer Software Assurance framework, underpins sponsor confidence by clarifying validation expectations. The United States accounts for most regional revenue, with Canada contributing specialized day-1 access programs for rare diseases and Mexico offering cost-effective Phase I units.
Asia-Pacific records the fastest regional expansion at 16.57% CAGR, reflecting harmonized trial policies, rising domestic R&D investment, and the promise of lower per-patient costs. China's streamlining of clinical-trial approval timelines, India's digital-health mission, and South Korea's telemedicine pilots collectively foster a receptive environment for decentralized study designs that require robust eCOA backbones. Nevertheless, divergent data-localization policies and language complexity demand that vendors deliver multi-tenant architectures with configurable sovereignty controls.
Europe, supported by EMA alignment and national eHealth agendas, remains a stable adopter. Germany's hospital digitalization budget and the UK's Medicines and Healthcare products Regulatory Agency sandbox stimulate uptake of sensor-driven outcomes in oncology and neurology. Meanwhile, GDPR compliance costs push smaller biotech to partner with established vendors holding pre-certified hosting zones, ensuring uninterrupted flow of electronic clinical outcome assessment solutions market transactions across the continent.
- Dassault Systemes
- Signant Health
- Clario (ERT Clinical)
- Oracle
- IQVIA
- Veeva Systems
- Parexel Intl. Corp.
- Kayentis
- Castor EDC
- WCG Clinical
- Mednet Solutions
- Aris Global
- Medable
- Suvoda
- TrialSpark
- eClinical Solutions
- OpenClinica
- Anju Software
- CRF Health (Parexel)
- OmniComm Systems
- Castor (Cloud Solutions)
Additional Benefits:
- The market estimate (ME) sheet in Excel format
- 3 months of analyst support
TABLE OF CONTENTS
1 Introduction
- 1.1 Study Assumptions & Market Definition
- 1.2 Scope of the Study
2 Research Methodology
3 Executive Summary
4 Market Landscape
- 4.1 Market Overview
- 4.2 Market Drivers
- 4.2.1 Growing outsourcing of clinical trials by pharma & biotech sponsors
- 4.2.2 Expansion of cloud / SaaS-based eClinical stacks
- 4.2.3 Regulatory push for patient-focused drug development
- 4.2.4 Accelerating shift to decentralized & BYOD trial models
- 4.2.5 BYOD-enabled wearables lower device costs & boost compliance
- 4.2.6 AI-driven adherence coaching lifts PRO data quality
- 4.3 Market Restraints
- 4.3.1 Data-security & privacy-breach concerns
- 4.3.2 High upfront implementation & validation costs
- 4.3.3 Shortage of eCOA-skilled clinical-ops workforce
- 4.3.4 Device heterogeneity risks measurement equivalence
- 4.4 Regulatory Landscape
- 4.5 Porters Five Forces Analysis
- 4.5.1 Threat of New Entrants
- 4.5.2 Bargaining Power of Buyers
- 4.5.3 Bargaining Power of Suppliers
- 4.5.4 Threat of Substitutes
- 4.5.5 Competitive Rivalry
5 Market Size & Growth Forecasts (Value, USD)
- 5.1 By Delivery Mode
- 5.1.1 Web-hosted
- 5.1.2 Cloud-based
- 5.1.3 On-premise
- 5.2 By Approach
- 5.2.1 Patient-Reported Outcome (PRO)
- 5.2.2 Clinician-Reported Outcome (ClinRO)
- 5.2.3 Observer-Reported Outcome (ObsRO)
- 5.2.4 Performance Outcome (PerfO)
- 5.3 By End User
- 5.3.1 Pharmaceutical and Biopharmaceutical Companies
- 5.3.2 Contract Research Organisations (CROs)
- 5.3.3 Others
- 5.4 By Geography
- 5.4.1 North America
- 5.4.1.1 United States
- 5.4.1.2 Canada
- 5.4.1.3 Mexico
- 5.4.2 Europe
- 5.4.2.1 Germany
- 5.4.2.2 United Kingdom
- 5.4.2.3 France
- 5.4.2.4 Italy
- 5.4.2.5 Spain
- 5.4.2.6 Rest of Europe
- 5.4.3 Asia-Pacific
- 5.4.3.1 China
- 5.4.3.2 Japan
- 5.4.3.3 India
- 5.4.3.4 Australia
- 5.4.3.5 South Korea
- 5.4.3.6 Rest of Asia-Pacific
- 5.4.4 Middle East and Africa
- 5.4.4.1 GCC
- 5.4.4.2 South Africa
- 5.4.4.3 Rest of Middle East and Africa
- 5.4.5 South America
- 5.4.5.1 Brazil
- 5.4.5.2 Argentina
- 5.4.5.3 Rest of South America
- 5.4.1 North America
6 Competitive Landscape
- 6.1 Market Concentration
- 6.2 Market Share Analysis
- 6.3 Company Profiles (includes Global level Overview, Market level overview, Core Segments, Financials as available, Strategic Information, Market Rank/Share, Products & Services, Recent Developments)
- 6.3.1 Dassault Systemes (Medidata)
- 6.3.2 Signant Health
- 6.3.3 Clario (ERT Clinical)
- 6.3.4 Oracle Corporation
- 6.3.5 IQVIA Inc.
- 6.3.6 Veeva Systems
- 6.3.7 Parexel Intl. Corp.
- 6.3.8 Kayentis
- 6.3.9 Castor EDC
- 6.3.10 WCG Clinical
- 6.3.11 Mednet Solutions
- 6.3.12 ArisGlobal
- 6.3.13 Medable Inc.
- 6.3.14 Suvoda
- 6.3.15 TrialSpark
- 6.3.16 eClinical Solutions LLC
- 6.3.17 OpenClinica
- 6.3.18 Anju Software
- 6.3.19 CRF Health (Parexel)
- 6.3.20 OmniComm Systems
- 6.3.21 Castor (Cloud Solutions)
7 Market Opportunities & Future Outlook
- 7.1 White-space & Unmet-Need Assessment














