
|
시장보고서
상품코드
1848053
북미의 임상시험 : 시장 점유율 분석, 산업 동향, 통계, 성장 예측(2025-2030년)North America Clinical Trials - Market Share Analysis, Industry Trends & Statistics, Growth Forecasts (2025 - 2030) |
||||||
북미의 임상시험 시장 규모는 2025년에 416억 2,000만 달러로 평가되었고, 2030년에 607억 6,000만 달러로 확대될 것으로 예측되며, CAGR은 5.83%를 나타낼 전망입니다.

이러한 지속적인 성장세는 북미가 글로벌 제약 혁신의 중심지로서 자리매김한 데 기인하며, 정교한 규제 절차, 성숙한 계약 연구 인프라, 그리고 강력한 투자자 신뢰가 이를 뒷받침하여 FDA 승인 건수의 4분의 3 이상을 차지하고 있습니다. AI 기반 데이터 분석의 채택 확대, 만성 질환 부담 증가, 분산형 및 적응형 설계에 대한 보건 당국의 지지는 2024년 3상 임상시험 비용이 3,658만 달러에 달했음에도 연구량을 현저히 증가시켰습니다. ICON의 PRA 헬스 사이언스 120억 달러 인수 사례에서 드러나듯 주요 CRO 간 통합은 기존 아웃소싱 모델에 도전하는 종단간 서비스 플랫폼을 창출하고 있습니다.
북미의 임상시험 시장 동향 및 인사이트
견고한 생명 과학 투자 및 혁신 생태계
2023년 주요 제약사들의 사상 최대 규모인 1,610억 달러의 연구개발(R&D) 지출은 현재 북미의 임상시험 시장을 주도하는 2상 및 3상 프로그램의 유입을 촉진했습니다. 콜버그의 월드와이드 클리니컬 트라이얼스(Worldwide Clinical Trials) 투자로 부각된 사모펀드(PE)의 모멘텀은 연구 시작 시점을 단축하고 치료 분야 전문화를 심화시키는 전용 사이트 네트워크를 확장시켰습니다. 바이오테크 벤처 자금은 2024년 30억 달러로 반등했으며, 신속한 개념 증명(PoC) 결과를 요구하는 AI 기반 플랫폼 기업들과의 연계가 증가하고 있습니다. 파렉셀-팔란티어(Parexel-Palantir)와 같은 전략적 제휴는 고급 분석을 시험 운영에 직접 통합하여 프로토콜 실행 가능성을 개선하고 중간 결정을 가속화합니다. 이러한 자본 흐름의 융합은 투자가 인프라 업그레이드를 촉진하고, 이는 다시 북미의 임상시험 시장 전반에 걸쳐 추가적인 스폰서 활동을 유치하는 선순환 구조를 강화합니다.
만성 및 희귀질환 부담 증가로 시험 수요 창출
고령화 인구와 심혈관대사성·신경퇴행성 질환 유병률 상승은 개발 프로그램의 탄탄한 파이프라인을 유지합니다. 북미는 알츠하이머 연구에서 불균형적으로 높은 비중을 차지하며, 해당 지역 파이프라인은 2033년까지 308억 달러 규모로 성장할 것으로 예상되는 알츠하이머 치료제 시장을 뒷받침합니다. GLP-1 수용체 작용매가 대사성 약물 시장을 주도함에 따라 당뇨병 및 비만 연구의 병행적 성장은 시험기관 활용도를 더욱 높입니다. 또한 정밀의학 기반 종양학 프로토콜이 전 세계 종양학 임상시험의 30%를 차지하며 미국에서 가장 빠르게 확장되면서 바이오마커 분석이 가능한 실험실 수요가 증가하고 있습니다. 적응형 설계에 대한 규제 유연성은 임상시험 자원을 변화하는 질병 생물학적 인사이트과 연계하는 신속한 프로토콜 수정을 가능케 하여 북미의 임상시험 시장의 성장 잠재력을 강화합니다.
복잡한 다중 관할권 규제 환경으로 인한 승인 지연
국가별 요구사항 차이로 지역별 연구 시작이 자주 지연됩니다. 멕시코 COFEPRIS의 평균 승인 기간은 3개월로 캐나다 보건부의 기본 일정보다 3배 길어, 데이터 조화를 복잡하게 만드는 단계적 시작 전략을 강요합니다. 관할권별 별도의 윤리위원회 승인 요건은 스폰서가 환자 등록 시작 전 순차적 승인을 확보해야 하므로 일정을 더욱 연장하고 비용을 증가시킵니다. 2025년 시행 예정인 ICH E6(R3) 개정안은 메타데이터 기준을 강화하여 현장 및 CRO에 새로운 디지털 추적 시스템을 요구할 것입니다. 이러한 요소들이 복합적으로 작용하여 규정 준수 복잡성과 행정적 부담을 가중시킴으로써, 북미의 임상시험 시장의 강력한 성장 곡선을 완화시키고 있습니다.
부문 분석
2024년 북미의 임상시험 시장에서 3상 프로그램은 49.12%의 비중을 차지했으며, 이는 승인 결정에 대규모 중추적 연구에 대한 규제 의존도를 반영하는 과도한 비중입니다. 바이오마커 검사, 영상학적 평가변수, 환자보고결과(PRO) 등이 기존 유효성 평가에 복잡성을 더하면서 2024년 3상 평균 비용은 3,658만 달러로 상승했으나, 기업들은 여전히 최초 또는 최고 수준의 지위를 확보하기 위해 후기 단계 시험에 자원을 집중하고 있습니다. 동시에, 기업들이 하류 단계에서의 손실을 완화하는 잘 특성화된 개념 증명 설계를 우선시함에 따라, 2030년까지 2상 프로그램에 대한 북미 임상 시험 시장 규모는 연평균 7.80%의 성장률을 보일 것으로 예상됩니다.
점점 더 많은 2상 연구가 중간 분석 결과를 바탕으로 조기 종료 또는 코호트 확장을 가능케 하는 적응형 기능(무익성 분석, 표본 크기 재추정, 용량 결정 알고리즘)을 활용함으로써 상업적 의사결정을 정밀화하고 자본을 절약하고 있습니다. 면역항암제 및 유전자 치료 모달리티가 엄격한 안전성 탐구를 요구함에 따라 1상 시험은 꾸준한 추진력을 유지하는 한편, 지불 주체의 실세계 증거 요구로 4상 시판 후 연구의 중요성이 부각되고 있습니다. 이러한 단계별 다각화는 예산 감시 하에서도 북미 임상시험 산업 전반이 균형 잡힌 성장 벡터를 유지하도록 보장합니다.
2024년 중재적 설계는 72.36% 점유율을 기록하며, 연구 치료법 평가 시 무작위 대조 환경에 대한 규제 기관의 선호도를 부각시켰습니다. 견고한 감독 체계와 확립된 통계적 관행은 중재적 연구를 북미의 임상시험 시장 내 주요 효능 주장의 골드 스탠다드로 공고히 합니다. 그러나 적응형 시험은 가속화되고 있으며, 중간 결과 데이터에 대응하는 설계 변경을 사전에 계획함으로써 효율성을 확보하는 스폰서들의 영향으로 8.68%의 연평균 성장률(CAGR)을 기록할 것으로 전망됩니다.
적응형 방법에 대한 FDA 지침의 축적은 제1종 오류 증가에 대한 역사적 우려를 완화시켜, 개발 일정을 단축하는 원활한 2상 및 3상 프로토콜을 통합하는 종양학 및 희귀질환 포트폴리오를 촉진하고 있습니다. 관찰 연구 및 확대 접근 연구는 설계 조합을 완성하며, 지불자 가치 자료에 정보를 제공하는 보완적 실세계 데이터를 공급합니다. 규제 당국이 마스터 프로토콜 및 플랫폼 시험에 점점 더 수용적인 태도를 보임에 따라, 적응형 설계를 위한 북미의 임상시험 시장 규모는 확대될 전망이며, 이질적인 환자 집단에서의 유연성을 강화할 것입니다.
기타 혜택
- 엑셀 형식 시장 예측(ME) 시트
- 3개월간의 애널리스트 지원
목차
제1장 서론
- 조사의 전제조건과 시장 정의
- 조사 범위
제2장 조사 방법
제3장 주요 요약
제4장 시장 상황
- 시장 개요
- 시장 성장 촉진요인
- 견고한 생명과학 투자 및 혁신 생태계
- 만성 및 희귀질환 부담 증가로 인한 임상시험 수요 창출
- 대규모 아웃소싱을 지지하는 성숙한 CRO/치험 시설 인프라
- FDA와 캐나다 보건성에 의한 분산형 및 적응형 디자인에의 지원책
- 하이브리드 시험을 가능하게 하는 고도의 데이터 공유와 디지털 헬스 백본
- 스폰서 자본을 유치하는 유리한 지식재산권 보호 및 보험급여 전망
- 시장 성장 억제요인
- 승인을 지연시키는 복잡한 다중 관할권 규제 환경
- 숙련된 임상시험 책임 의사, 임상시험 코디네이터, 임상시험 직원의 부족
- 인플레이션에 의한 시설 운영비 및 참가자 모집비의 상승
- 다양한 환자 코호트에 대한 경쟁 격화에 의한 등록 지연
- 규제 상황
- Porter's Five Forces 분석
- 신규 참가업체의 위협
- 구매자/소비자의 협상력
- 공급기업의 협상력
- 대체품의 위협
- 경쟁 기업간 경쟁 관계의 강도
제5장 시장 규모 및 성장 예측
- 단게별
- 1상
- 2상
- 3상
- 4상
- 조사 설계별
- 중재적/치료 연구
- 관찰 연구
- 확장 액세스 연구
- 서비스 유형별
- 프로토콜 디자인과 실현 가능성
- 시설의 특정과 시작
- 약사 신청 및 승인
- 임상시험 모니터링
- 데이터 관리 및 생물통계학
- 의학 문서 작성
- 기타 서비스
- 치료영역별
- 암 영역
- 순환기
- 신경
- 감염증
- 대사질환(당뇨병, 비만증)
- 면역학/자가면역
- 기타 치료 영역
- 스폰서 유형별
- 제약 및 바이오 제약 기업
- 의료기기 기업
- 학술기관 및 연구기관
- 정부 및 비영리 단체
- 지역별
- 미국
- 캐나다
- 멕시코
제6장 경쟁 구도
- 시장 집중도
- 시장 점유율 분석
- 기업 프로파일
- IQVIA
- Laboratory Corp of America(Covance)
- Parexel International
- ICON plc
- Syneos Health
- Charles River Laboratories
- Medpace Holdings
- Wuxi AppTec
- PRA Health Sciences
- Clinipace
- Pharmaceutical Product Development(PPD)
- Thermo Fisher Scientific
- Catalent Pharma Solutions
제7장 시장 기회와 전망
HBR 25.11.10The North America clinical trials market size stands at USD 41.62 billion in 2025 and is forecast to expand to USD 60.76 billion by 2030, reflecting a 5.83% CAGR.
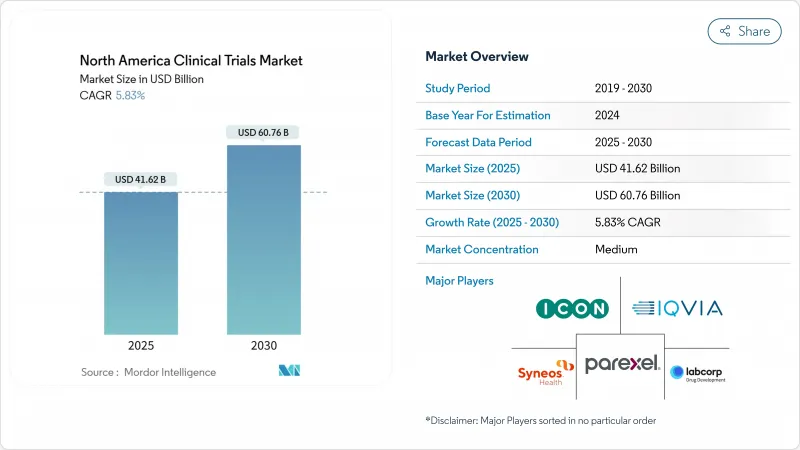
This sustained trajectory is rooted in North America's position as the global epicenter for pharmaceutical innovation, reinforced by sophisticated regulatory pathways, mature contract-research infrastructure, and strong investor confidence that collectively underpin more than three-quarters of FDA approvals. Intensifying adoption of AI-enabled data analytics, a rising chronic-disease burden, and health-authority endorsement of decentralized and adaptive designs have markedly lifted study volumes, even as Phase III trial costs reached USD 36.58 million in 2024. Consolidation among leading CROs, exemplified by ICON's USD 12 billion acquisition of PRA Health Sciences, is yielding end-to-end service platforms that challenge traditional outsourcing models.
North America Clinical Trials Market Trends and Insights
Robust Life-Sciences Investment & Innovation Ecosystem
Record R&D spending of USD 161 billion by major pharmaceutical firms in 2023 fueled an influx of Phase II and Phase III programs that now anchor the North America clinical trials market. Private-equity momentum-highlighted by Kohlberg's investment in Worldwide Clinical Trials-has scaled dedicated site networks that shorten study start-up timelines and deepen therapeutic specialization. Venture funding into biotech rebounded to USD 3 billion in 2024 and is increasingly tied to AI-driven platform companies that demand rapid proof-of-concept readouts. Strategic alliances such as Parexel-Palantir integrate advanced analytics directly into trial operations, improving protocol feasibility and accelerating interim decisions. These converging capital flows reinforce a virtuous cycle where investment begets infrastructure upgrades that, in turn, attract further sponsor activity across the North America clinical trials market.
High Chronic- & Rare-Disease Burden Generating Trial Demand
An aging population and escalating prevalence of cardiometabolic and neurodegenerative disorders sustain a robust pipeline of development programs. North America accounts for a disproportionate share of Alzheimer's research, with the regional pipeline feeding an Alzheimer's therapeutics market expected to reach USD 30.8 billion by 2033. Parallel growth in diabetes and obesity studies further elevates site utilization as GLP-1 receptor agonists dominate the metabolic drug landscape. Moreover, oncology precision-medicine protocols now comprise 30% of global oncology trials and expand fastest in the United States, intensifying demand for biomarker-enabled laboratories. Regulatory flexibility toward adaptive designs enables swift protocol amendments that align trial resources with shifting disease-biology insights, reinforcing upside for the North America clinical trials market.
Complex Multi-Jurisdictional Regulatory Landscape Prolonging Approvals
Divergent country requirements frequently delay regional study launches: Mexico's COFEPRIS averages three months for approvals, triple Health Canada's default timeline, forcing staggered start-up strategies that complicate data harmonization. Separate ethics-committee mandates across jurisdictions further extend timelines and inflate costs as sponsors must secure sequential green-lights before enrollment begins. Forthcoming ICH E6(R3) revisions in 2025 will tighten metadata standards, necessitating new digital traceability systems at sites and CROs. Combined, these factors temper the otherwise strong growth curve of the North America clinical trials market by adding compliance complexity and administrative overhead.
Other drivers and restraints analyzed in the detailed report include:
- Mature CRO/Site Infrastructure Supporting Large-Scale Outsourcing
- Supportive FDA & Health Canada Initiatives for Decentralized and Adaptive Designs
- Shortage of Skilled Investigators, Coordinators and Site Staff
For complete list of drivers and restraints, kindly check the Table Of Contents.
Segment Analysis
Phase III programs commanded 49.12% of the North America clinical trials market in 2024, an outsized footprint that reflects regulatory reliance on large pivotal studies for approval decisions. Average Phase III spending climbed to USD 36.58 million in 2024 as biomarker testing, imaging endpoints, and patient-reported outcomes layered complexity onto traditional efficacy measures, yet sponsors continue to funnel resources into these late-stage trials to secure first-in-class or best-in-class labels. Concurrently, the North America clinical trials market size for Phase II programs is projected to expand at a 7.80% CAGR through 2030 as companies prioritize well-characterized proof-of-concept designs that mitigate downstream attrition.
A growing share of Phase II studies leverage adaptive features-futility analyses, sample-size re-estimation, and dose-finding algorithms-that enable early termination or cohort expansion based on interim reads, sharpening commercial decision-making and conserving capital. Phase I trials maintain steady momentum as immuno-oncology and gene-therapy modalities demand rigorous safety exploration, while Phase IV post-marketing studies rise in prominence amid payer insistence on real-world evidence. Such diversification across phases ensures that the wider North America clinical trials industry retains balanced growth vectors even under budget scrutiny.
Interventional designs held 72.36% share in 2024, underscoring regulatory preference for randomized controlled environments when evaluating investigational therapies. Robust oversight frameworks and well-established statistical conventions solidify interventional studies as the gold standard for primary efficacy claims within the North America clinical trials market. Yet adaptive trials are gaining velocity, forecast to post an 8.68% CAGR as sponsors capture efficiencies by prospectively planning design modifications that respond to interim outcomes data.
The growing repository of FDA guidance on adaptive methods has alleviated historical concerns regarding type-I error inflation, prompting oncology and rare-disease portfolios to incorporate seamless Phase II/III protocols that compress development timelines. Observational and expanded-access studies round out the design mix, supplying complementary real-world data that inform payer value dossiers. With regulatory authorities increasingly receptive to master protocols and platform trials, the North America clinical trials market size for adaptive designs is set to widen, enhancing flexibility in heterogeneous patient populations.
The North America Clinical Trials Market Report is Segmented by Phase (Phase I, and More), Study Design (Interventional/Treatment Studies, and More), Service Type (Protocol Design & Feasibility, and More), Sponsor Type (Pharmaceutical and Biopharmaceutical Companies, and More), Therapeutic Area (Oncology, and More), Geography (United States, Canada, and Mexico). The Market Forecasts are Provided in Terms of Value (USD).
List of Companies Covered in this Report:
- IQVIA
- Laboratory Corp of America (Covance)
- Parexel International
- ICON
- Syneos Health
- Charles River
- Medpace Holdings
- WuXi App Tec
- PRA Health Sciences
- Clinipace
- Pharmaceutical Product Development (PPD)
- Thermo Fisher Scientific
- Catalent Pharma Solutions
Additional Benefits:
- The market estimate (ME) sheet in Excel format
- 3 months of analyst support
TABLE OF CONTENTS
1 Introduction
- 1.1 Study Assumptions & Market Definition
- 1.2 Scope of the Study
2 Research Methodology
3 Executive Summary
4 Market Landscape
- 4.1 Market Overview
- 4.2 Market Drivers
- 4.2.1 Robust Life-Sciences Investment & Innovation Ecosystem
- 4.2.2 High Chronic- & Rare-Disease Burden Generating Trial Demand
- 4.2.3 Mature CRO/Site Infrastructure Supporting Large-Scale Outsourcing
- 4.2.4 Supportive FDA & Health Canada Initiatives for Decentralized and Adaptive Designs
- 4.2.5 Advanced Data-Sharing & Digital-Health Backbone Enabling Hybrid Trials
- 4.2.6 Favorable IP Protection & Reimbursement Outlook Attracting Sponsor Capital
- 4.3 Market Restraints
- 4.3.1 Complex Multi-Jurisdictional Regulatory Landscape Prolonging Approvals
- 4.3.2 Shortage Of Skilled Investigators, Coordinators and Site Staff
- 4.3.3 Inflation-Driven Escalation Of Site Operating and Participant-Recruitment Costs
- 4.3.4 Intensifying Competition For Diverse Patient Cohorts Slowing Enrollment
- 4.4 Regulatory Landscape
- 4.5 Porter's Five Forces Analysis
- 4.5.1 Threat of New Entrants
- 4.5.2 Bargaining Power of Buyers/Consumers
- 4.5.3 Bargaining Power of Suppliers
- 4.5.4 Threat of Substitute Products
- 4.5.5 Intensity of Competitive Rivalry
5 Market Size & Growth Forecasts (Value, USD)
- 5.1 By Phase
- 5.1.1 Phase I
- 5.1.2 Phase II
- 5.1.3 Phase III
- 5.1.4 Phase IV
- 5.2 By Study Design
- 5.2.1 Interventional / Treatment Studies
- 5.2.2 Observational Studies
- 5.2.3 Expanded Access Studies
- 5.3 By Service Type
- 5.3.1 Protocol Design & Feasibility
- 5.3.2 Site Identification & Start-up
- 5.3.3 Regulatory Submission & Approval
- 5.3.4 Clinical Trial Monitoring
- 5.3.5 Data Management & Biostatistics
- 5.3.6 Medical Writing
- 5.3.7 Other Service Types
- 5.4 By Therapeutic Area
- 5.4.1 Oncology
- 5.4.2 Cardiovascular
- 5.4.3 Neurology
- 5.4.4 Infectious Diseases
- 5.4.5 Metabolic Disorders (Diabetes, Obesity)
- 5.4.6 Immunology / Autoimmune
- 5.4.7 Other Therapeutic Areas
- 5.5 By Sponsor Type
- 5.5.1 Pharmaceutical & Biopharmaceutical Companies
- 5.5.2 Medical Device Companies
- 5.5.3 Academic & Research Institutes
- 5.5.4 Government & Non-profit Organizations
- 5.6 Geography
- 5.6.1 United States
- 5.6.2 Canada
- 5.6.3 Mexico
6 Competitive Landscape
- 6.1 Market Concentration
- 6.2 Market Share Analysis
- 6.3 Company Profiles (includes Global level Overview, Market level overview, Core Segments, Financials as available, Strategic Information, Market Rank/Share, Products & Services, Recent Developments)
- 6.3.1 IQVIA
- 6.3.2 Laboratory Corp of America (Covance)
- 6.3.3 Parexel International
- 6.3.4 ICON plc
- 6.3.5 Syneos Health
- 6.3.6 Charles River Laboratories
- 6.3.7 Medpace Holdings
- 6.3.8 Wuxi AppTec
- 6.3.9 PRA Health Sciences
- 6.3.10 Clinipace
- 6.3.11 Pharmaceutical Product Development (PPD)
- 6.3.12 Thermo Fisher Scientific
- 6.3.13 Catalent Pharma Solutions
7 Market Opportunities & Future Outlook
- 7.1 White-space & Unmet-need Assessment

















