
|
시장보고서
상품코드
1851706
듀센 근이영양증 치료 : 시장 점유율 분석, 산업 동향, 통계, 성장 예측(2025-2030년)Duchenne Muscular Dystrophy Treatment - Market Share Analysis, Industry Trends & Statistics, Growth Forecasts (2025 - 2030) |
||||||
듀센 근이영양증 치료 시장은 2025년 34억 2,000만 달러로 평가되었고 CAGR은 19.08%를 나타낼 것으로 예측되며 2030년에는 81억 9,000만 달러에 달할 전망입니다.

획기적인 유전자 치료법, 규제 가속화, 지속적인 벤처 투자가 치료 기준을 재정의하며 완화적 치료에서 지속 가능한 질병 수정 치료로 전환을 이끌고 있습니다. FDA의 델란디스트로겐 목세파르보벡(4세 이상 소아 대상), 최초의 비스테로이드계 약물 기비노스타트, 코르티코스테로이드 대체제 바모롤론의 확대 승인은 분자 접근법이 주류를 이루는 다중 모드 생태계를 뒷받침합니다. 플랫폼 기술이 성숙해짐에 따라 투자자들의 관심은 여전히 높으며, 이는 올리고뉴클레오타이드 및 CRISPR 혁신 기업들의 기록적인 자금 조달에서 드러난다. 대기업들의 프로그램 중단으로 촉발된 경쟁 재편은 신생 기업들에게 백스페이스 기회를 열어주면서 동시에 확장 가능한 벡터 제조에 대한 집중도를 높이고 있습니다. 지리적 모멘텀은 아시아태평양 지역에 집중되어 있으며, 일본과 중국의 규제 당국이 심사를 가속화하면서 해당 지역은 평균 이상의 매출 성장과 다양한 임상 시험 활동을 기대할 수 있게 되었습니다.
세계의 듀센 근이영양증 치료 시장 동향 및 인사이트
DMD의 질병 부담 증가
남아 출생 3,500-6,000명 중 1명이 영향을 받는다는 인식이 확산되면서 국가 등록 제도와 신생아 선별 검사 프로그램이 도입되어 임상시험 대상 인구를 확대하고 조기 치료 개입을 촉진하고 있습니다. 영국의 점유율 연구에 따르면 현재 10만 명당 3.23명의 발병률이 보고되며, 환자가 보행 가능 단계에서 인공호흡기 보조 단계로 전환함에 따라 직접 의료 비용은 약 3배 가까이 증가합니다. 1970년 이전 출생자의 18.2년에서 1990-1999년 출생 코호트의 24년으로 기대 수명이 연장되면서 치료 기간이 길어지고 시장 수요가 확대되고 있습니다.
신규 치료에 대한 투자 증가
벤처 및 전략적 자본이 지속적으로 유입되고 있습니다. CureDuchenne은 2014년 이후 30억 달러 이상의 후속 자금을 유치했으며, Dyne Therapeutics는 2024년 한 번의 자금 조달로 3억 달러를 확보했습니다. Sarepta-Arrowhead의 siRNA 협력 및 Sanofi-Fulcrum의 후성유전적 조절 협력과 같은 협력은 대형 제약사들의 희귀질환 포트폴리오에 대한 의지를 보여주는 반면, 자선 벤처 부문은 초기 발견에 여전히 중요한 역할을 하고 있습니다.
표준화된 임상 유효성 평가 항목의 부족
크레아틴 키나아제 같은 바이오마커의 변동성은 연구 간 비교를 복잡하게 하여, 미세디스트로핀 발현과 더 밀접한 상관관계를 보이는 요중 N-말단 티틴 같은 대체 지표의 검증 노력을 촉진하고 있습니다. FDA와 EMA의 상이한 지침은 계획 수립을 복잡하게 하며, 업데이트된 소아 보행 분류는 기존 결과 측정 기준과 현대적 기준 간의 격차를 드러냅니다.
부문 분석
분자 기반 치료법은 2024년 매출에서 가장 큰 비중(듀센형 근이영양증 치료 시장의 61.34%)을 차지했습니다. 해당 세분 시장은 최초 출시 유전자 치료제, 효율성이 향상된 엑손 스키핑 화학물질, 신흥 리드스루(read-through) 제제의 등장으로 2030년까지 연평균 복합 성장률(CAGR) 19.89%로 확장될 전망입니다. 분자 치료제 부문의 뒤쉔형 근이영양증 치료 시장 규모는 2030년까지 57억 달러에 달할 전망이며, 이는 델란디스트로겐 목세파르보벡(delandistrogene moxeparvovec)에 대한 지속적인 보험 적용과 CRISPR 기반 치료제 파이프라인 성숙도를 반영합니다. 돌연변이 억제 접근법은 확대된 적응증 승인으로 계속 혜택을 보는 한편, 바이러스 벡터에 의존하지 않는 디스트로핀 발현 키메라 세포는 초기 임상 시험을 진행 중입니다.
분자 치료법 내 경쟁 역학은 차별화된 디스트로핀 발현에 달려 있습니다. 직접 비교 평가에서 DYNE-251은 기존 에테플리르센(0.3%) 대비 3.71%의 발현률을 보였습니다. 제조 혁신은 여전히 관문적 요소로 남아 있으나, 최근 폴리-A 시퀀싱 및 트랜스진 카세트 구조 최적화로 인해 생물반응기 용량 리터당 기능적 수율이 향상되고 있습니다. 스테로이드성 및 비스테로이드성 항염증제는 특히 유전자 치료 접근이 지연되는 상황에서 보완적 역할을 유지하며, 만성 치료 프로토콜의 수익 기반을 보존하고 병용 요법 연구를 뒷받침하고 있습니다.
지역 분석
북미는 확립된 희귀의약품 프레임워크, 광범위한 민간 보험 적용 범위, 벤처 자금의 깊이 덕분에 2024년 매출 기여도 41.29%로 선두를 달렸습니다. 해당 지역의 뒤쉔 근이영양증 치료 시장 규모는 14억 달러를 넘어섰으며, 신생아 선별 검사 의무화의 꾸준한 확대가 치료 대상 인구 기반을 확대할 것으로 예상됩니다. 캐나다와 멕시코는 조화된 라벨링을 채택하여 국경을 넘는 치료 연속성을 촉진하는 동시에 유전자 치료 환급을 위한 현지 경로를 구축하고 있습니다.
아시아태평양 지역은 2030년까지 연평균 성장률(CAGR) 19.98%로 가장 빠르게 성장할 것으로 전망됩니다. 일본은 2025년 5월 재생의학 경로를 통해 델란디스트로겐 모크세파르보벡을 승인하며 7년간의 조건부 판매권을 부여했습니다. 중국은 바모롤론에 대한 우선 심사 제도를 통해 제조 이전 완료 후 첫 번째 도입 물결을 준비 중이며, 국가 지원 CRISPR 프로젝트는 글로벌 스폰서들을 현지 생산 능력 구축을 위한 합작 투자로 이끌고 있습니다. 인도, 한국, 호주는 연구자 네트워크와 희귀질환 등록 시스템을 확대하며 임상시험 참여를 공동으로 확대하고 있습니다.
유럽은 규제 가속화 프로그램과 밀집된 학술-의료 네트워크를 통해 핵심적 역할을 유지합니다. 2025년 4월 기비노스타트(givinostat)의 조건부 승인은 EMA가 대리종결점을 수용하면서도 강력한 시판 후 의무를 요구하는 입장을 재확인했습니다. 독일과 프랑스는 결과 기반 계약 하에 고비용 치료제를 보상하는 법정 보험 제도의 지원으로 초기 도입국 지위를 유지하고 있습니다. 동유럽 국가들은 추가 치료 대안이 시장에 출시되면 가격 협상이 예상됨에 따라 시범 보상 프로젝트를 점진적으로 도입 중입니다.
기타 혜택 :
- 엑셀 형식 시장 예측(ME) 시트
- 3개월간의 애널리스트 지원
목차
제1장 서론
- 조사의 전제조건과 시장의 정의
- 조사 범위
제2장 조사 방법
제3장 주요 요약
제4장 시장 상황
- 시장 개요
- 시장 성장 촉진요인
- DMD 질병 부담 증가
- 신규 치료에 대한 투자 증가
- 안티센스 엑손 스키핑 약물의 승인 가속화
- 희귀의약품 인센티브 및 우선 심사 바우처
- CRISPR 플랫폼 계약으로 가속화되는 유전자 편집 파이프라인
- 환자 모집 개선을 위한 분산형 임상시험
- 시장 성장 억제요인
- 표준화된 임상 유효성 평가 항목의 부족
- 높은 치료 비용 및 보험 적용 장벽
- 고용량 AAV 벡터 제조 병목
- 오프타겟 유전자 편집에 관한 규제의 불확실성
- 규제 상황
- Porter's Five Forces 분석
- 구매자의 협상력
- 공급기업의 협상력
- 신규 참가업체의 위협
- 대체품의 위협
- 경쟁 기업간 경쟁 관계
제5장 시장 규모와 성장 예측
- 치료 접근법별
- 분자 기반
- 돌연변이 억제
- 엑손 스키핑
- 스테로이드
- 비스테로이드성 항염증제
- 기타
- 분자 기반
- 투여 경로별
- 정맥 주사
- 피하
- 경구
- 유통 채널별
- 병원 약국
- 소매 약국
- 온라인 약국
- 지역별
- 북미
- 미국
- 캐나다
- 멕시코
- 유럽
- 독일
- 영국
- 프랑스
- 이탈리아
- 스페인
- 기타 유럽
- 아시아태평양
- 중국
- 일본
- 인도
- 호주
- 한국
- 기타 아시아태평양
- 중동 및 아프리카
- GCC
- 남아프리카
- 기타 중동 및 아프리카
- 남미
- 브라질
- 아르헨티나
- 기타 남미
- 북미
제6장 경쟁 구도
- 시장 집중도
- 시장 점유율 분석
- 기업 프로파일
- Sarepta Therapeutics
- PTC Therapeutics
- Nippon Shinyaku(NS Pharma)
- Pfizer
- Italfarmaco
- Santhera Pharmaceuticals
- FibroGen
- BioMarin
- Roche/Genentech
- Wave Life Sciences
- Solid Biosciences
- Dyne Therapeutics
- Edgewise Therapeutics
- Regenxbio
- Alexion(AstraZeneca Rare Disease)
- Genethon
- Eli Lilly
- Dystrogen Therapeutics
- Entrada Therapeutics
제7장 시장 기회와 장래의 전망
HBR 25.11.17The Duchenne muscular dystrophy treatment market reached a market size of USD 3.42 billion in 2025 and is projected to expand at a 19.08% CAGR, culminating in USD 8.19 billion by 2030.
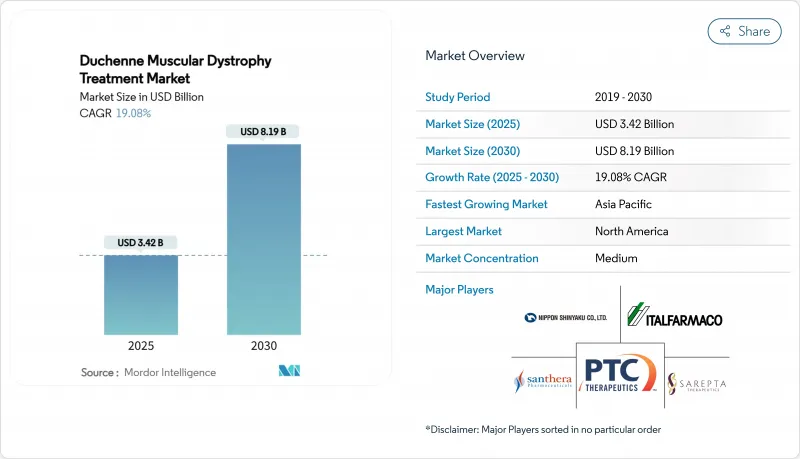
Breakthrough gene therapies, regulatory acceleration, and sustained venture investment are redefining therapeutic standards, shifting care from palliative regimens toward durable disease-modifying interventions. The FDA's broadened approval of delandistrogene moxeparvovec for children aged 4 and older, the first-in-class non-steroidal agent givinostat, and the corticosteroid alternative vamorolone together underpin a multimodal ecosystem where molecular approaches dominate . Investor appetite remains robust as platform technologies mature, illustrated by record capital raises for oligonucleotide and CRISPR innovators. Competitive realignment, sparked by program discontinuations among larger firms, has opened white-space opportunities for emerging players while intensifying focus on scalable vector manufacturing. Geographic momentum centers on Asia-Pacific, where regulators in Japan and China have accelerated reviews, positioning the region for above-average revenue growth and diversified clinical trial activity.
Global Duchenne Muscular Dystrophy Treatment Market Trends and Insights
Rising Disease Burden of DMD
Growing recognition that 1 in 3,500-6,000 male births are affected has prompted national registries and newborn screening programs that enlarge trial-eligible populations and encourage earlier therapeutic intervention . Point prevalence studies in England now cite 3.23 cases per 100,000, while direct medical costs rise nearly three-fold as patients transition from ambulatory to ventilator-assisted stages. Life expectancy improvements-from 18.2 years for those born before 1970 to 24 years for the 1990-1999 cohort-extend treatment duration and amplify market demand.
Increasing Investments in Novel Therapies
Venture and strategic capital continue to flow; CureDuchenne has catalyzed over USD 3 billion in follow-on funding since 2014, and Dyne Therapeutics secured USD 300 million in a single 2024 raise. Collaborations such as Sarepta-Arrowhead for siRNA and Sanofi-Fulcrum on epigenetic modulation illustrate big-pharma commitment to rare-disease portfolios, while philanthropic venture arms remain vital to early discovery .
Lack of Standardised Clinical Efficacy Endpoints
Variability in biomarkers such as creatine kinase complicates cross-study comparisons, prompting validation efforts for alternatives like urinary N-terminal titin, which correlates more closely with microdystrophin expression. Divergent FDA and EMA guidance adds planning complexity, while updated pediatric gait classifications expose gaps between historical outcome measures and contemporary standards.
Other drivers and restraints analyzed in the detailed report include:
- Approval Momentum for Antisense Exon-Skipping Drugs
- Orphan-Drug Incentives & Priority Review Vouchers
- High Therapy Cost & Reimbursement Hurdles
For complete list of drivers and restraints, kindly check the Table Of Contents.
Segment Analysis
Molecular-based interventions generated the largest contribution to 2024 revenue, representing 61.34% of the Duchenne muscular dystrophy treatment market. That segment is projected to expand at 19.89% CAGR to 2030 on the back of first-to-market gene therapies, increasingly efficient exon-skipping chemistries, and emerging read-through agents. The Duchenne muscular dystrophy treatment market size for molecular categories is poised to reach USD 5.7 billion by 2030, reflecting sustained reimbursement for delandistrogene moxeparvovec and pipeline maturation among CRISPR constructs. Mutational-suppressing approaches continue to benefit from expanded labeling, while dystrophin-expressing chimeric cells are progressing through early trials without reliance on viral vectors.
Competitive dynamics within molecular modalities hinge on differentiated dystrophin expression; DYNE-251 delivered 3.71% expression versus 0.3% from legacy eteplirsen in head-to-head assessments. Manufacturing innovation remains a gating factor, yet recent optimizations in poly-A sequencing and transgene cassette architecture are lifting functional yields per liter of bioreactor capacity. Steroidal and non-steroidal anti-inflammatories retain a complementary role, particularly where gene therapy access is delayed, preserving revenue baselines for chronic care protocols and underpinning combination-therapy investigation.
The Duchenne Muscular Dystrophy Treatment Market Report is Segmented by Therapeutic Approach (Molecular-Based, Steroidal Therapy, Nsaids, Others), Route of Administration (Intravenous, Sub-Cutaneous, Oral), Distribution Channel (Hospital Pharmacies, Retail Pharmacies, Online Pharmacies), and Geography (North America, Europe, Asia-Pacific, and More). The Market Forecasts are Provided in Terms of Value (USD).
Geography Analysis
North America led with 41.29% revenue contribution in 2024, buoyed by an established orphan-drug framework, broad private insurance coverage, and venture funding depth. The Duchenne muscular dystrophy treatment market size in the region surpassed USD 1.4 billion, and steady rollout of newborn screening mandates is expected to enlarge the treated population base. Canada and Mexico are adopting harmonized labeling, promoting cross-border treatment continuity while forging local pathways for gene-therapy reimbursement.
Asia-Pacific is forecast to be the fastest-advancing territory at 19.98% CAGR through 2030. Japan approved delandistrogene moxeparvovec under its regenerative medicine pathway in May 2025, granting seven-year conditional marketing rights. China's priority review of vamorolone positions the mainland for first-wave uptake once manufacturing transfers conclude, and state-supported CRISPR initiatives are drawing global sponsors into joint ventures for localized production capacity. India, South Korea, and Australia are scaling investigator networks and rare-disease registries, collectively widening clinical trial participation.
Europe maintains a pivotal role through coordinated regulatory accelerators and dense academic-medical networks. Conditional approval of givinostat in April 2025 underscored the EMA's willingness to accept surrogate endpoints while stipulating robust post-marketing commitments. Germany and France remain early adopters, backed by statutory insurance schemes that reimburse high-cost therapies under outcomes-based contracts. Eastern European nations are gradually introducing pilot reimbursement projects, anticipating price negotiations once additional therapeutic alternatives reach market.
- Sarepta Therapeutics
- PTC Therapeutics
- Nippon Shinyaku (NS Pharma)
- Pfizer
- Italfarmaco
- Santhera Pharmaceuticals
- FibroGen
- BioMarin
- Roche / Genentech
- Wave Life Sciences
- Solid Biosciences
- Dyne Therapeutics
- Edgewise Therapeutics
- Regenxbio
- Alexion (AstraZeneca Rare Disease)
- Genethon
- Eli Lilly and Company
- Dystrogen Therapeutics
- Entrada Therapeutics
Additional Benefits:
- The market estimate (ME) sheet in Excel format
- 3 months of analyst support
TABLE OF CONTENTS
1 Introduction
- 1.1 Study Assumptions & Market Definition
- 1.2 Scope of the Study
2 Research Methodology
3 Executive Summary
4 Market Landscape
- 4.1 Market Overview
- 4.2 Market Drivers
- 4.2.1 Rising disease burden of DMD
- 4.2.2 Increasing investments in novel therapies
- 4.2.3 Approval momentum for antisense exon-skipping drugs
- 4.2.4 Orphan-drug incentives & priority review vouchers
- 4.2.5 CRISPR platform deals accelerating gene-editing pipelines
- 4.2.6 Decentralised trials improving patient recruitment
- 4.3 Market Restraints
- 4.3.1 Lack of standardised clinical efficacy endpoints
- 4.3.2 High therapy cost & reimbursement hurdles
- 4.3.3 Manufacturing bottlenecks for high-dose AAV vectors
- 4.3.4 Regulatory uncertainty on off-target gene editing
- 4.4 Regulatory Landscape
- 4.5 Porters Five Forces Analysis
- 4.5.1 Bargaining Power of Buyers
- 4.5.2 Bargaining Power of Suppliers
- 4.5.3 Threat of New Entrants
- 4.5.4 Threat of Substitutes
- 4.5.5 Competitive Rivalry
5 Market Size & Growth Forecasts (Value, USD)
- 5.1 By Therapeutic Approach
- 5.1.1 Molecular-Based
- 5.1.1.1 Mutation Suppressing
- 5.1.1.2 Exon Skipping
- 5.1.2 Steroidal Therapy
- 5.1.3 NSAIDs
- 5.1.4 Others
- 5.1.1 Molecular-Based
- 5.2 By Route of Administration
- 5.2.1 Intravenous
- 5.2.2 Sub-cutaneous
- 5.2.3 Oral
- 5.3 By Distribution Channel
- 5.3.1 Hospital Pharmacies
- 5.3.2 Retail Pharmacies
- 5.3.3 Online Pharmacies
- 5.4 By Geography
- 5.4.1 North America
- 5.4.1.1 United States
- 5.4.1.2 Canada
- 5.4.1.3 Mexico
- 5.4.2 Europe
- 5.4.2.1 Germany
- 5.4.2.2 United Kingdom
- 5.4.2.3 France
- 5.4.2.4 Italy
- 5.4.2.5 Spain
- 5.4.2.6 Rest of Europe
- 5.4.3 Asia-Pacific
- 5.4.3.1 China
- 5.4.3.2 Japan
- 5.4.3.3 India
- 5.4.3.4 Australia
- 5.4.3.5 South Korea
- 5.4.3.6 Rest of Asia-Pacific
- 5.4.4 Middle East and Africa
- 5.4.4.1 GCC
- 5.4.4.2 South Africa
- 5.4.4.3 Rest of Middle East and Africa
- 5.4.5 South America
- 5.4.5.1 Brazil
- 5.4.5.2 Argentina
- 5.4.5.3 Rest of South America
- 5.4.1 North America
6 Competitive Landscape
- 6.1 Market Concentration
- 6.2 Market Share Analysis
- 6.3 Company Profiles (includes Global level Overview, Market level overview, Core Segments, Financials as available, Strategic Information, Market Rank/Share for key companies, Products & Services, and Recent Developments)
- 6.3.1 Sarepta Therapeutics
- 6.3.2 PTC Therapeutics
- 6.3.3 Nippon Shinyaku (NS Pharma)
- 6.3.4 Pfizer
- 6.3.5 Italfarmaco
- 6.3.6 Santhera Pharmaceuticals
- 6.3.7 FibroGen
- 6.3.8 BioMarin
- 6.3.9 Roche / Genentech
- 6.3.10 Wave Life Sciences
- 6.3.11 Solid Biosciences
- 6.3.12 Dyne Therapeutics
- 6.3.13 Edgewise Therapeutics
- 6.3.14 Regenxbio
- 6.3.15 Alexion (AstraZeneca Rare Disease)
- 6.3.16 Genethon
- 6.3.17 Eli Lilly
- 6.3.18 Dystrogen Therapeutics
- 6.3.19 Entrada Therapeutics
7 Market Opportunities & Future Outlook
- 7.1 White-space & Unmet-need Assessment

















