
|
시장보고서
상품코드
1911368
의약품 제조 : 시장 점유율 분석, 업계 동향과 통계, 성장 예측(2026-2031년)Pharmaceutical Manufacturing - Market Share Analysis, Industry Trends & Statistics, Growth Forecasts (2026 - 2031) |
||||||
의약품 제조 시장은 2025년의 5,059억 7,000만 달러에서 2026년에는 5,554억 달러로 성장할 것으로 보입니다. 2026-2031년에 걸쳐 CAGR 9.77%로 성장을 지속하여, 2031년까지 8,852억 1,000만 달러에 달할 것으로 예측됩니다.

의약품 제조 시장은 첨단 기술, 바이오시밀러 생산 능력 확대, 지역별 다각화된 공급망으로 진화하고 있으며, 이러한 요소들이 종합적으로 작용하여 제조사들이 증가하는 세계의 수요를 충족하고 강화된 규제를 준수할 수 있도록 지원합니다. 연속 공정 경제성, 리쇼어링 인센티브, 시장 출시 기간을 단축하고 다품종 소량 생산 전략을 지원하는 인공지능 기반 품질 관리 시스템이 이러한 추세를 더욱 가속화하고 있습니다. CDMO 기업들은 생물학적 제제 수요를 충족하기 위해 급속히 규모를 확장하고 있으며, 북미 기업들은 국내 생산 능력에 자본을 집중 투자하고 있고, 아시아태평양 지역 정부들은 규제 체계를 개선하고 있어, 이 모든 요소가 의약품 제조 시장의 지속적인 두 자릿수 성장을 위한 기반을 마련하고 있습니다.
세계의 의약품 제조 시장 동향 및 인사이트
주요 제약 기업에 의한 R&D 투자 증가
주요 제약 기업은 연구개발 및 제조 시설 업그레이드에 전례 없는 자금을 투입하고 있으며, 세계의 의약품 지출은 2032년까지 1조 9,000억 달러에 달할 것으로 전망됩니다. 생물학적 제제만으로도 연간 매출 6,000억 달러를 넘어설 것으로 예상되어, 기업들은 연구개발 및 제조 예산을 조정하여 시설 설계가 임상 파이프라인을 직접 지원하도록 하고 있습니다. 노바티스와 로슈의 500억 달러 이상 자본 배분 사례는 통합 R&D-제조 전략이 방사성 리간드 및 바이오의약품 프로그램을 가속화할 수 있음을 보여주며, AI 기반 공정 최적화는 이미 의약품 제조 시장 전반의 파일럿 플랜트에서 처리량을 20% 향상시켰습니다.
연속 제조 가속
연속 공정 도입은 시설 면적을 70% 줄이고 운영 비용을 최대 50% 절감하여 의약품 제조 시장 내 배치 생산에서 전환할 즉각적인 경제적 근거를 제공합니다. FDA의 ICH Q13 시행은 기업에 명확한 규제 경로를 제시하여 연속 생산된 의약품 및 백신의 심사 기간 단축으로 이어진다. 화이자와 일라이 릴리의 승인 제품은 상업적 타당성을 입증했으며, 신흥 플랫폼은 현재 나노물질 및 지질 나노입자 mRNA 제품을 포괄합니다.
세계의 의약품 가격 압력과 비용 억제 정책
미국의 인플레이션 감축법(IRA)은 메디케어 협상을 허용하여 출시 가격 인하 및 리베이트 노출 증가로의 전환을 가속화합니다. 2024년 1월 1일 기준 규제 당국은 453건의 브랜드 가격 인상을 기록했으며, 이는 30건의 인하로 상쇄되어 제조사 마진을 압박하는 강력한 감시를 시사합니다. 유럽의 '중요 의약품법(Critical Medicines Act)'과 같은 제안은 현지 생산을 장려하면서 동시에 상환액을 제한함으로써 병행 압박을 가해, 기업들이 수익성 방어를 위해 공격적인 자동화를 추구하도록 강제합니다.
부문 분석
2025년 시점에서 저분자 의약품은 광범위한 세계 인프라와 확립된 규제 경로에 힘입어 의약품 제조 시장의 60.58%를 차지했습니다. 생물학적 제제 및 바이오시밀러는 절대치로는 소규모이지만 특허 만료와 표적 요법 수요 증가의 혜택을 받으며 10.22%의 연평균 복합 성장률(CAGR)로 성장이 예상됩니다.
제조 복잡성은 생산 능력 차별화를 주도합니다. 일회용 바이오리액터와 폐쇄형 분석 시스템이 생물학적 제제 공장을 지배하는 반면, 저분자 의약품은 점차 완전 연속식 탁상형 라인으로 전환되고 있습니다. AI 기반 제어 전략은 두 분자군 모두 의약품 제조 시장 전반에서 수율 안정화와 배치 실패 위험 감소를 가능케 하는 통합적 테마입니다.
2025년 기준 사내 생산 시설은 기존 역량과 지적 재산권 고려 사항에 힘입어 58.79%의 점유율을 유지했습니다. 그러나 연평균 10.69% 성장 중인 CDMO(위탁개발 및 위탁생산) 기업들은 세포 및 유전자 치료제, mRNA 플랫폼, 고활성 원료의약품 부문에서 핵심 역할을 수행하고 있습니다. 바이오시밀러와 첨단 치료법이 증가함에 따라 의뢰사들은 분석 개발, 충전 및 완성, 포장을 신속하게 생산 능력을 조정할 수 있는 파트너사에 아웃소싱하고 있습니다.
하이브리드 접근법은 핵심 자산을 위한 사내 핵심 라인과 수요 변동이 큰 제품을 위한 아웃소싱 생산을 결합하여 기업이 고정 비용 노출을 제한할 수 있게 합니다. 이 전략은 의약품 제조 시장의 균형 잡힌 성장을 가능하게 하면서 CDMO가 모듈식 플랜트 설계와 디지털 통합 부문에서 혁신할 수 있도록 합니다.
지역별 분석
북미는 2025년 37.25%의 시장 점유율을 유지했으며, 로슈, 엘리 릴리, 존슨앤드존슨이 각각 500억 달러 이상을 미국 프로젝트에 투자하며 발표한 2,000억 달러 이상의 생산 능력 확장이 이를 뒷받침했습니다. 행정명령 14293호는 국내 승인을 간소화하는 한편, 연속 공정 파일럿 프로젝트는 혁신 리더십을 보여줍니다. 캐나다와 멕시코는 규제 경로 조화와 비용 경쟁력 있는 원료의약품(API) 생산 시설을 통해 지역 네트워크를 보완합니다.
유럽은 독일, 프랑스, 이탈리아, 스페인, 영국에 확립된 클러스터에 의해 견고한 지위를 유지하고 있습니다. 제안 중 중요한 의약품법은 공급의 안전성과 지속가능성 기준의 향상을 목표로 하여, 그린 케미스트리나 순환형 제조 파일럿에 대한 투자를 촉진합니다. 유럽 의약품청(EMA)의 연속 및 모듈식 플랜트에 관한 가이던스는 각국 당국의 제휴를 촉진해, 선진 치료제의 유럽의 전역에서 시장 진입을 가속시킵니다.
아시아태평양은 2031년까지 연평균 복합 성장률(CAGR) 12.4%로 가장 빠르게 성장하는 지역으로 인도의 확대하는 CRDMO 생태계와 중국의 mRNA 및 단일클론항체 생산 능력의 증강이 주도하고 있습니다. 일본, 한국, 호주는 고순도 바이오 의약품을 공급하고 싱가포르와 베트남은 숙련 노동력과 투자 촉진 정책을 배경으로 충전 및 포장 프로젝트를 모으고 있습니다. 규제조화의 이니셔티브와 자동화에 대한 정부 보조금은 의약품 제조 시장의 지속적인 지역 성장을 뒷받침하고 있습니다.
기타 혜택 :
- 엑셀 형식 시장 예측(ME) 시트
- 애널리스트의 3개월간 지원
자주 묻는 질문
목차
제1장 서론
- 조사의 전제조건과 시장 정의
- 조사 범위
제2장 조사 방법
제3장 주요 요약
제4장 시장 상황
- 시장 개요
- 시장 성장 촉진요인
- 대형 제약사의 연구개발 투자 증가
- 연속 생산 방식의 가속화
- 기존 시설의 AI, IoT, 자동화 통합
- 주요 특허 만료에 따른 바이오시밀러 급증
- API 생산의 국내 회귀와 현지화
- 지속가능성 및 순환형 제조 이니셔티브
- 시장 성장 억제요인
- 세계의 의약품 가격 압력과 비용 억제 정책
- 중요 원재료공급 체인 혼란
- 첨단 제조 기술의 규제 복잡성
- 바이오테크놀러지 제조의 숙련 노동력의 부족
- 규제 상황
- Porter's Five Forces 분석
- 공급기업 협상력
- 구매자 협상력
- 신규 참가업체 위협
- 대체품 위협
- 경쟁 기업간 경쟁 관계
제5장 시장 규모와 성장 예측(금액 : 달러)
- 분자 유형별
- 생물학적 제제 및 바이오시밀러(고분자)
- 기존 의약품(저분자)
- 제조방법별
- 사내
- CMO/CDMO
- 제제별
- 정제
- 캡슐
- 주사제
- 국소 및 경피 흡수제
- 비강 및 폐 스프레이
- 기타
- 제조 기술별
- 배치
- 연속
- 일회용
- 용도별
- 종양학
- 당뇨병
- 심혈관
- 신경학
- 호흡기
- 기타
- 처방전유형별
- 처방약
- 시판약
- 지역별
- 북미
- 미국
- 캐나다
- 멕시코
- 유럽
- 독일
- 영국
- 프랑스
- 이탈리아
- 스페인
- 기타 유럽
- 아시아태평양
- 중국
- 일본
- 인도
- 호주
- 한국
- 기타 아시아태평양
- 중동 및 아프리카
- GCC
- 남아프리카
- 기타 중동 및 아프리카
- 남미
- 브라질
- 아르헨티나
- 기타 남미
- 북미
제6장 경쟁 구도
- 시장 집중도
- 시장 점유율 분석
- 기업 프로파일
- Pfizer Inc.
- F. Hoffmann-La Roche AG
- Novartis AG
- Merck & Co.
- Sanofi
- GSK
- Eli Lilly and Company
- AbbVie
- AstraZeneca
- Takeda
- Bristol Myers Squibb
- Amgen
- Novo Nordisk
- Sun Pharma
- Boehringer Ingelheim
- Teva
- Cipla
- Lonza Group AG
- Catalent
제7장 시장 기회와 장래의 전망
HBR 26.01.29The Pharmaceutical Manufacturing market is expected to grow from USD 505.97 billion in 2025 to USD 555.4 billion in 2026 and is forecast to reach USD 885.21 billion by 2031 at 9.77% CAGR over 2026-2031.
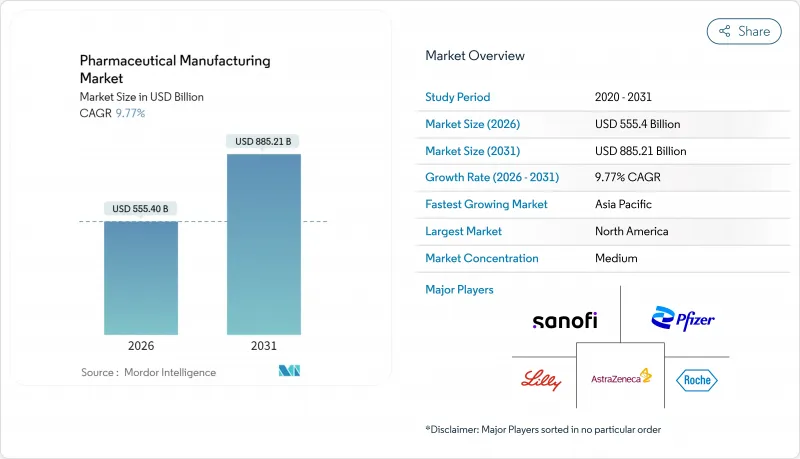
The pharmaceutical manufacturing market is moving toward advanced technologies, greater biosimilar capacity, and regionally diversified supply chains that collectively help manufacturers satisfy rising global demand and comply with tighter regulations. Momentum is reinforced by continuous-processing economics, reshoring incentives, and artificial-intelligence-enabled quality control systems that shorten time-to-market cycles and support high-mix, low-volume production strategies. CDMOs are scaling rapidly to meet biologics demand, North American companies are pouring capital into domestic capacity, and Asia-Pacific governments are refining regulatory frameworks, all of which position the pharmaceutical manufacturing market for sustained double-digit growth.
Global Pharmaceutical Manufacturing Market Trends and Insights
Rising R&D Investments by Big Pharma
Large pharmaceutical companies are channeling unprecedented funds into research, development, and manufacturing upgrades, with global drug spending projected to reach USD 1.9 trillion by 2032. Biologics alone are set to surpass USD 600 billion in annual revenue, prompting firms to align R&D and manufacturing budgets so that facility design directly supports clinical pipelines. Capital allocations of USD 50 billion or more from Novartis and Roche illustrate how integrated R&D-manufacturing strategies can accelerate radioligand and biologics programs, while AI-enabled process optimization has already boosted throughput by 20% in pilot plants across the pharmaceutical manufacturing market.
Acceleration of Continuous Manufacturing
Continuous-processing adoption cuts facility footprints by 70% and operating costs by up to 50%, providing an immediate economic rationale for transition from batch production within the pharmaceutical manufacturing market. The FDA's implementation of ICH Q13 gives companies a clear regulatory pathway, leading to faster review times for continuous-manufactured drugs and vaccines. Approved products from Pfizer and Eli Lilly validate commercial viability, while emerging platforms now cover nanomaterials and lipid-nanoparticle mRNA products.
Global Drug Pricing Pressures and Cost-Containment Policies
The U.S. Inflation Reduction Act authorizes Medicare negotiations, accelerating a shift toward lower launch prices and higher rebate exposure. On 1 January 2024, regulators recorded 453 brand-price hikes offset by 30 decreases, signaling intense scrutiny that compresses manufacturer margins. European proposals such as the Critical Medicines Act add parallel pressure by incentivizing local production while capping reimbursement, compelling firms to pursue aggressive automation to defend profitability.
Other drivers and restraints analyzed in the detailed report include:
- Integration of AI, IoT, and Automation across Legacy Facilities
- Biosimilar Surge Following Major Patent Expirations
- Supply-Chain Disruptions for Critical Inputs
For complete list of drivers and restraints, kindly check the Table Of Contents.
Segment Analysis
Small-molecule drugs controlled 60.58% of pharmaceutical manufacturing market share in 2025, supported by extensive global infrastructure and proven regulatory pathways. Biologics and biosimilars, although smaller in absolute terms, are expected to grow at a 10.22% CAGR, benefiting from patent expirations and rising demand for targeted therapies.
Manufacturing complexity drives capacity differentiation: single-use bioreactors and closed-loop analytics dominate biologics plants, while small molecules increasingly shift to fully-continuous tabletop lines. AI-driven control strategies are a unifying theme, enabling both molecule classes to stabilize yields and reduce batch-failure risk across the pharmaceutical manufacturing market.
In-house sites held 58.79% share in 2025, sustained by legacy capabilities and intellectual-property considerations. Yet CDMOs, growing at 10.69% CAGR, have become central for cell-and-gene therapy, mRNA platforms, and high-potency APIs. As biosimilars and advanced modalities multiply, sponsors are outsourcing analytical development, fill-finish, and packaging to partners that can flex capacity quickly.
Hybrid approaches combine core in-house lines for flagship assets with outsourced manufacturing for variable-demand products, allowing companies to limit fixed-cost exposure. This strategy positions the pharmaceutical manufacturing market for balanced growth while enabling CDMOs to innovate in modular plant design and digital integration.
The Pharmaceutical Manufacturing Market Report is Segmented by Molecule Type (Biologics & Biosimilars (Large Molecules), Conventional Drugs (Small Molecules)), Manufacturing Mode (In-House, CMO/CDMO), Formulation (Tablets, Capsules, and More), Manufacturing Technology, Application, Prescription Type, and Geography (North America, Europe, Asia-Pacific, and More). The Market Forecasts are Provided in Terms of Value (USD).
Geography Analysis
North America retained 37.25% market share in 2025, anchored by more than USD 200 billion in announced capacity expansions from Roche, Eli Lilly, and Johnson & Johnson, each committing USD 50 billion-plus to U.S. projects. Executive Order 14293 streamlines domestic approvals, while continuous-processing pilots showcase innovation leadership. Canada and Mexico complement the regional network through pathway harmonization and cost-competitive API sites.
Europe maintains a strong position through established clusters in Germany, France, Italy, Spain, and the United Kingdom. The proposed Critical Medicines Act aims to improve supply security and sustainability standards, driving investments in green chemistry and circular-manufacturing pilots. EMA guidance on continuous and modular plants helps align national authorities and accelerates market entry for advanced therapies across the continent.
Asia-Pacific is the fastest-growing region at 12.4% CAGR to 2031, led by India's expanding CRDMO ecosystem and China's mRNA and monoclonal antibody capacity additions. Japan, South Korea, and Australia supply high-purity biologics, while Singapore and Vietnam attract fill-finish projects that benefit from skilled labor pools and pro-investment policies. Regulatory convergence initiatives and government subsidies for automation position the pharmaceutical manufacturing market for sustained regional momentum.
- Pfizer
- Roche
- Novartis
- Merck
- Sanofi
- GlaxoSmithKline
- Eli Lilly and Company
- Abbvie
- AstraZeneca
- Takeda Pharmaceuticals
- Bristol-Myers Squibb
- Amgen
- Novo Nordisk
- Sun Pharmaceuticals Industries
- Boehringer Ingelheim
- Teva Pharmaceutical Industries
- Cipla
- Lonza Group
- Catalent
Additional Benefits:
- The market estimate (ME) sheet in Excel format
- 3 months of analyst support
TABLE OF CONTENTS
1 Introduction
- 1.1 Study Assumptions & Market Definition
- 1.2 Scope of the Study
2 Research Methodology
3 Executive Summary
4 Market Landscape
- 4.1 Market Overview
- 4.2 Market Drivers
- 4.2.1 Rising R&D Investments by Big Pharma
- 4.2.2 Acceleration of Continuous Manufacturing
- 4.2.3 Integration of AI, IoT, and Automation across Legacy Facilities
- 4.2.4 Biosimilar Surge Following Major Patent Expirations
- 4.2.5 Reshoring and Localization of API Production
- 4.2.6 Sustainability and Circular Manufacturing Initiatives
- 4.3 Market Restraints
- 4.3.1 Global Drug Pricing Pressures and Cost Containment Policies
- 4.3.2 Supply Chain Disruptions for Critical Inputs
- 4.3.3 Regulatory Complexity for Advanced Manufacturing Technologies
- 4.3.4 Skilled Workforce Shortage in Biotech Manufacturing
- 4.4 Regulatory Landscape
- 4.5 Porter's Five Forces Analysis
- 4.5.1 Bargaining Power of Suppliers
- 4.5.2 Bargaining Power of Buyers
- 4.5.3 Threat of New Entrants
- 4.5.4 Threat of Substitutes
- 4.5.5 Competitive Rivalry
5 Market Size & Growth Forecasts (Value in USD)
- 5.1 By Molecule Type
- 5.1.1 Biologics & Biosimilars (Large Molecule)
- 5.1.2 Conventional Drugs (Small Molecule )
- 5.2 By Manufacturing Mode
- 5.2.1 In-house
- 5.2.2 CMO/CDMO
- 5.3 By Formulation
- 5.3.1 Tablets
- 5.3.2 Capsules
- 5.3.3 Injectables
- 5.3.4 Topical & Transdermal
- 5.3.5 Nasal & Pulmonary Sprays
- 5.3.6 Others
- 5.4 By Manufacturing Technology
- 5.4.1 Batch
- 5.4.2 Continuous
- 5.4.3 Single-Use
- 5.5 By Application
- 5.5.1 Oncology
- 5.5.2 Diabetes
- 5.5.3 Cardiovascular
- 5.5.4 Neurology
- 5.5.5 Respiratory
- 5.5.6 Others
- 5.6 By Prescription Type
- 5.6.1 Prescription Drugs
- 5.6.2 Over-the-Counter (OTC)
- 5.7 By Geography
- 5.7.1 North America
- 5.7.1.1 United States
- 5.7.1.2 Canada
- 5.7.1.3 Mexico
- 5.7.2 Europe
- 5.7.2.1 Germany
- 5.7.2.2 United Kingdom
- 5.7.2.3 France
- 5.7.2.4 Italy
- 5.7.2.5 Spain
- 5.7.2.6 Rest of Europe
- 5.7.3 Asia-Pacific
- 5.7.3.1 China
- 5.7.3.2 Japan
- 5.7.3.3 India
- 5.7.3.4 Australia
- 5.7.3.5 South Korea
- 5.7.3.6 Rest of Asia-Pacific
- 5.7.4 Middle East & Africa
- 5.7.4.1 GCC
- 5.7.4.2 South Africa
- 5.7.4.3 Rest of Middle East & Africa
- 5.7.5 South America
- 5.7.5.1 Brazil
- 5.7.5.2 Argentina
- 5.7.5.3 Rest of South America
- 5.7.1 North America
6 Competitive Landscape
- 6.1 Market Concentration
- 6.2 Market Share Analysis
- 6.3 Company Profiles (includes Global level Overview, Market level overview, Core Segments, Financials as available, Strategic Information, Market Rank/Share for key companies, Products & Services, and Recent Developments)
- 6.3.1 Pfizer Inc.
- 6.3.2 F. Hoffmann-La Roche AG
- 6.3.3 Novartis AG
- 6.3.4 Merck & Co.
- 6.3.5 Sanofi
- 6.3.6 GSK
- 6.3.7 Eli Lilly and Company
- 6.3.8 AbbVie
- 6.3.9 AstraZeneca
- 6.3.10 Takeda
- 6.3.11 Bristol Myers Squibb
- 6.3.12 Amgen
- 6.3.13 Novo Nordisk
- 6.3.14 Sun Pharma
- 6.3.15 Boehringer Ingelheim
- 6.3.16 Teva
- 6.3.17 Cipla
- 6.3.18 Lonza Group AG
- 6.3.19 Catalent
7 Market Opportunities & Future Outlook
- 7.1 White-space & Unmet-need Assessment

















